 湘雅博爱康复医院医学伦理委员会药物器械初始伦理审查申请表.docx
湘雅博爱康复医院医学伦理委员会药物器械初始伦理审查申请表.docx
《湘雅博爱康复医院医学伦理委员会药物器械初始伦理审查申请表.docx》由会员分享,可在线阅读,更多相关《湘雅博爱康复医院医学伦理委员会药物器械初始伦理审查申请表.docx(3页珍藏版)》请在优知文库上搜索。
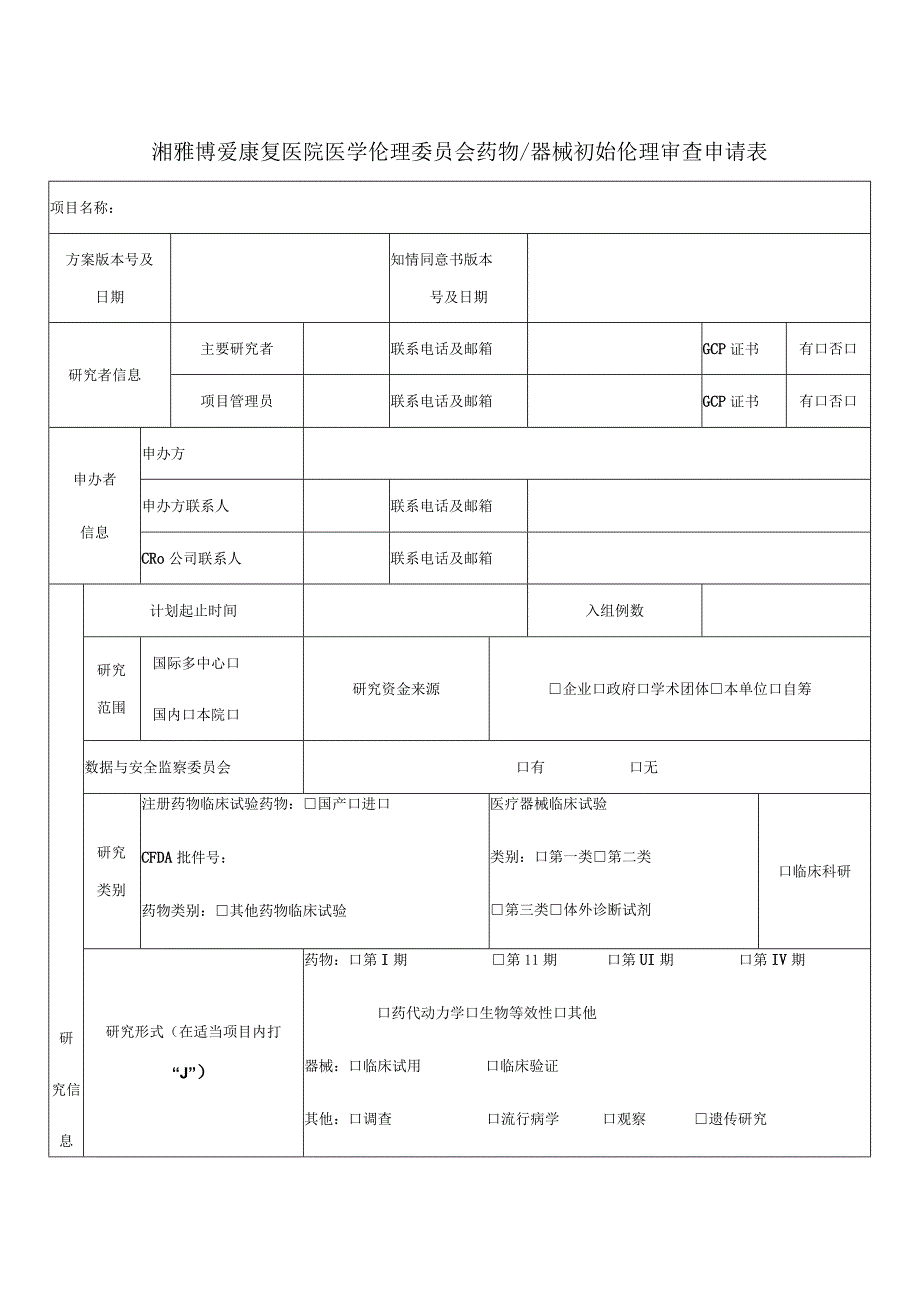
1、湘雅博爱康复医院医学伦理委员会药物/器械初始伦理审查申请表项目名称:方案版本号及日期知情同意书版本号及日期研究者信息主要研究者联系电话及邮箱GCP证书有口否口项目管理员联系电话及邮箱GCP证书有口否口申办者信息申办方申办方联系人联系电话及邮箱CRo公司联系人联系电话及邮箱研究信息计划起止时间入组例数研究范围国际多中心口国内口本院口研究资金来源企业口政府口学术团体本单位口自筹数据与安全监察委员会口有口无研究类别注册药物临床试验药物:国产口进口CFDA批件号:药物类别:其他药物临床试验医疗器械临床试验类别:口第一类第二类第三类体外诊断试剂口临床科研研究形式(在适当项目内打“J”)药物:口第I期第1
2、1期口第UI期口第IV期口药代动力学口生物等效性口其他器械:口临床试用口临床验证其他:口调查口流行病学口观察遗传研究招募人群特征健康者患者弱势群体口孕妇年龄范围()弱势群体(选择弱势群体,填写此项)口认知障碍或因健康状况而没有能力做出知情同意的成人精神疾病者申办者/PI的学生或雇员教育/经济地位低下的人员儿童/未成年人口疾病终末期患者囚犯口不适用孕妇(选择孕妇,填写此项)没有通过经济利益引诱期中止妊娠口研究人员不参与中止妊娠的决策研究人员不参与新生儿生存能力的判断口不适用知情同意获取知情同意人研究者合作研究者研究医生口研究护士口研究助理知情同意签字受试者签字口法定代理人签字免除知情同意研究病例
3、/生物标本的二次利用口利用以往临床诊疗中获得的病例的研究口不适用免除知情同意签字签字的知情同意书会对受试者的隐私构成不正当威胁,联系受试者真实身份和研究的唯一记录是知情同意文件,并且主要风险只来自于受试者身份或隐私的泄露。研究对受试者的风险不大于最小风险,并且如果脱离“研究”背景,相同情况下的行为或程序不要求签书面知情同意。如访谈研究、邮件/电话调查。不适用主要研究者声明我保证以上信息真实准确,并负责该临床试验全过程中的质量保证,承诺该临床试验数据真实可靠,符合CFDA药物临床试验质量管理规范(GCP)要求。如有失实,愿意承担相关责任。本人与该研究项目之间的利益冲突:不存在口存在日期:主要研究者(签名):伦理接收人(签名):日期:


- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 博爱 康复 医院 医学 伦理 委员会 药物 器械 初始 审查 申请表
 优知文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
优知文库所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 2022自身免疫性肝炎的管理JSH临床实践指南主要内容.docx
2022自身免疫性肝炎的管理JSH临床实践指南主要内容.docx
